细胞内蛋白质结构和功能的研究
1. 研究背景
众所周知,细胞内是一个非常复杂和拥挤的环境,细菌和哺乳动物细胞内生物大分子的浓度分别可以达到300-400 g/L和50-250 g/L,占据了细胞内体积的~30% - 40%(图 1)。由于细胞环境复杂,目前在胞内进行蛋白质结构表征的研究难度很大。传统的晶体衍射、冷冻电镜、核磁共振技术(NMR)和荧光等技术已经在蛋白质研究中发挥了巨大作用,但主要在离体条件下进行的。荧光方法能用于细胞内蛋白质的研究,但是分辨率较差。相对而言,细胞内NMR是一种无损的非侵入性技术,能够在原子水平上提供组成、结构、相互作用和动态性过程的定量信息,是理想的活细胞内蛋白质结构和动态性研究工具,因此NMR在细胞原位环境开展蛋白质结构和功能研究已成为国内外重要的研究方向。
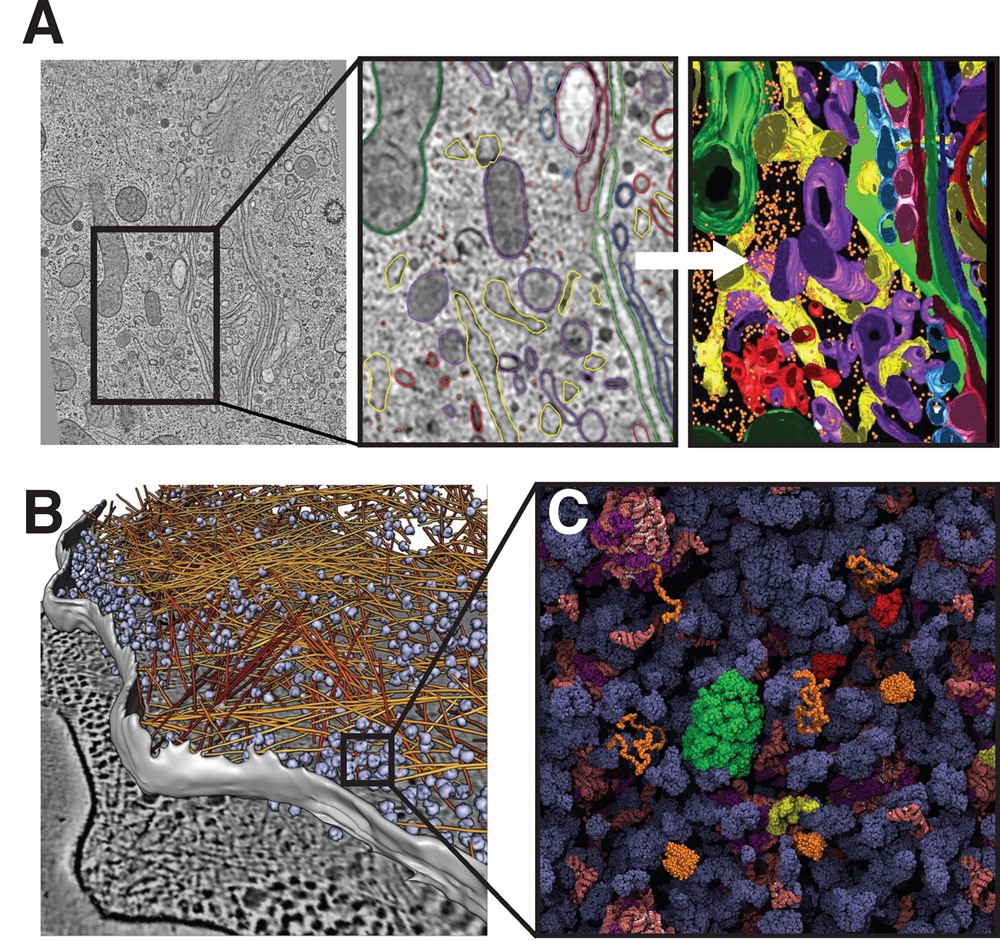
图 1. 哺乳动物细胞(A)和细菌(B-C)的生物分子模型图
2. 代表性研究成果
1)细胞内蛋白质折叠和解折叠动态性机制解析
该研究工作以IgG结合蛋白质GB3的两个突变体MutX 和 MutY(图2)为研究体系,采用核磁共振技术,对其在细胞内的折叠态与解折叠态之间的构象交换进行了表征。结果表明蛋白在细胞内和缓冲溶液中的折叠和解折叠的动力学过程有较大差异(图2),折叠态、解折叠态和过渡态的相对自由能受到了细胞环境的影响(图3)。进一步研究表明,这一影响主要来自于细胞内的五级作用力,但这种作用力不足以改变蛋白质的折叠态和解折叠态的构象。该研究结果也表明离体条件下的蛋白质功能研究需要在细胞环境中进行独立验证。相关研究发表于Journal of the American Chemical Society杂志上(J. Am. Chem. Soc., 2019, 141, 11363−11366,Top 1区IF: 15.42)。审稿人认为“这项工作是一个非常有趣的新发现,并认为该工作是一个具有潜在重要影响的新发现”。( https://pubs.acs.org/doi/full/10.1021/jacs.9b04435 )
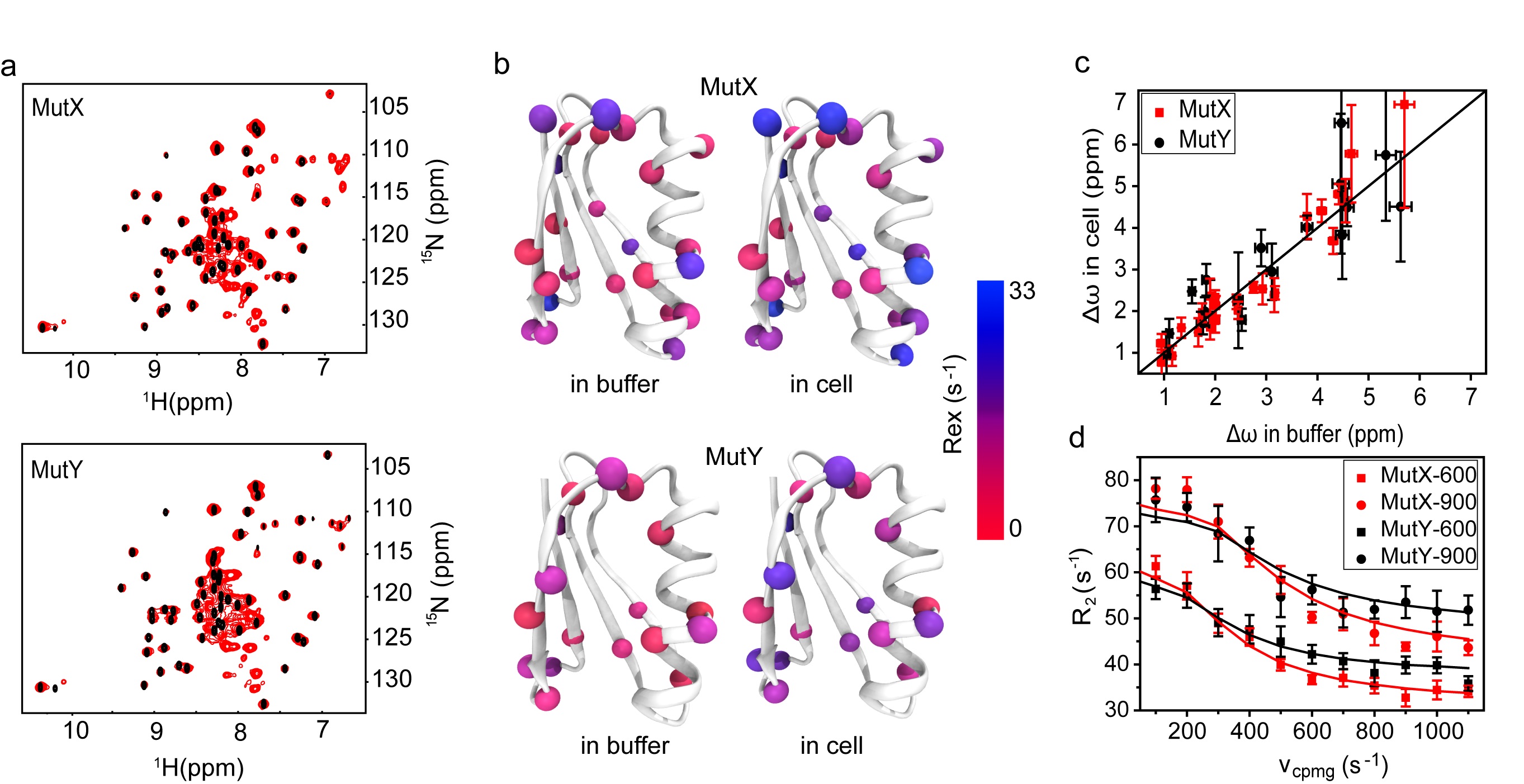
图2. GB3突变体 MutX和MutY在细胞内和水溶液的折叠与解折叠构象交换动力学的比较。

图3. GB3突变体 MutX和MutY在不同条件下的自由能图。
2)细胞内蛋白质静电相互作用的直接测量
静电相互作用在许多重要生物反应过程中起到至关重要的作用,如酶催化、蛋白质-蛋白质相互作用、蛋白质-DNA/RNA相互作用和H+的转移等生物反应。但绝大多数蛋白质都是在细胞中执行其功能,复杂细胞环境可以扰动蛋白质的静电相互作用,这对蛋白质功能的实施非常重要,但这种扰动能达到何种程度目前尚不清楚。
该代表性工作主要应用核磁共振技术和双突变循环的(double mutational cycle,DMC)方法,测量了细胞内IgG结合蛋白质GB3中的8对电荷相互作用,并与在胞外条件测量的结果进行比较。结果表明,蛋白质GB3中5对电荷的静电相互作用没有发生明显变化,另外3对电荷的静电相互作用减弱了70%以上(图4)。进一步的研究表明,细胞内蛋白质静电相互作用强弱与蛋白质折叠转移自由能有关,折叠态和解折叠态的转移自由能都影响细胞内蛋白质静电相互作用,尽管后者通常比前者的影响更大(图5)。研究结果凸显了在细胞内直接研究蛋白质相互作用和蛋白质功能的重要性。该工作发表于JACS杂志上(J. Am. Chem. Soc., 2021, 143, 19606−19613,Top 1区IF: 15.42),并被该期刊选为亮点文章。审稿人认为这项工作“很不错且具有创新性,并认为该研究结果对生化和生物界的学者来说,都具有潜在的广泛兴趣”。(https://doi.org/10.1021/jacs.1c10154)
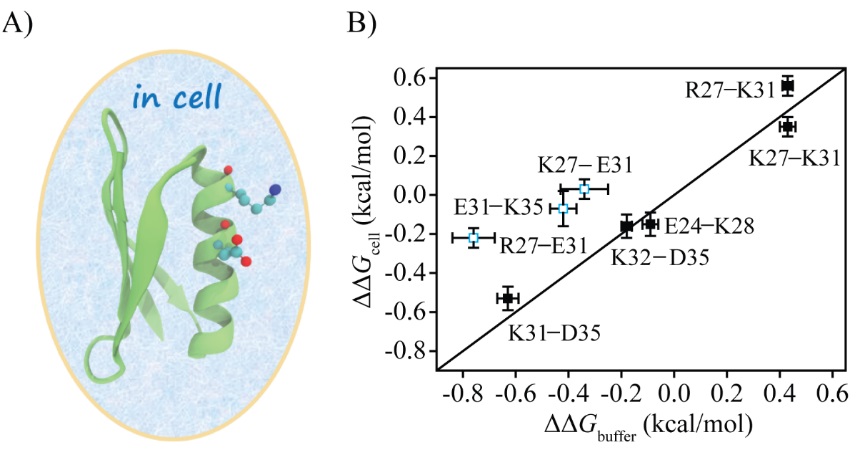
图4. 在胞外条件和细胞内测量的GB3电荷对之间静电相互作用的相关性。
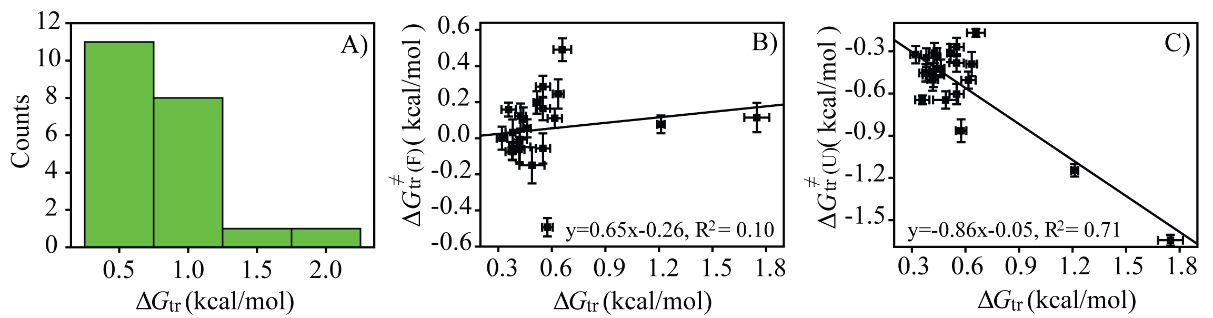
图5. 蛋白质折叠转移自由能(ΔGtr)的性质:A) 所有测量的GB3突变体的折叠转移自由能; B)和C)分别为折叠转移自由能和折叠态相对转移自由能及解折叠态相对转移自由能之间的相关性。
3)解析细胞原位环境蛋白质构象动态性的影响机制
从蛋白质最初的合成、功能发挥及最后被降解的阶段,蛋白质的动态性对于细胞生命的各个方面都是至关重要的。例如蛋白质的折叠、识别、别构和酶催化都与蛋白质的构象动态性有关。但是细胞内蛋白质构象动态性的研究很少,复杂的细胞环境是否影响蛋白质构象动态性是一个重要且悬而未决的问题。
该研究发展一个基于蛋白质主链15N纵向弛豫速率R2的核磁共振技术方法,利用细胞内和水溶液中蛋白质15N R2弛豫速率差异 (ΔR2) 来表征细胞内蛋白质主链的动态性。以IgG结合蛋白质GB3L为例(图6A),测量了细胞内蛋白质GB3L的构象动态性,通过序参数 S2(0代表最柔性;1代表最刚性)表征发现,蛋白质环 loop1区域具有很强的柔性,以及α1 和β3 间的 linker也有较大柔性(图 1B)。细胞内蛋白质构象动态性与水溶液中获得的结果趋势一致,但是数值上有显著差异。更为重要的是, loop1的突变体表明,疏水和带正电荷的突变与周围大分子的相互作用变强,会让该区域在细胞内蛋白质环loop1变得更加刚性(水溶液中无相应变化), 即抑制了蛋白质环 loop1区域的动态性(图 7A-B)。利用不同表面电荷特性的纳米颗粒作为大分子模型,可以在体外重现该现象(图 7C-D)。该工作证明了细胞内蛋白质与其他生物大分子的弱相互作用会抑制蛋白质环loop的构象动态性,进而可能影响蛋白质的功能。这项工作也强调了细胞环境对蛋白质环loop构象动态性的作用,并凸显了在细胞内直接研究蛋白质性质和功能的重要性。该工作发表于Science Advances杂志上(10.1126/sciadv.adg9141)
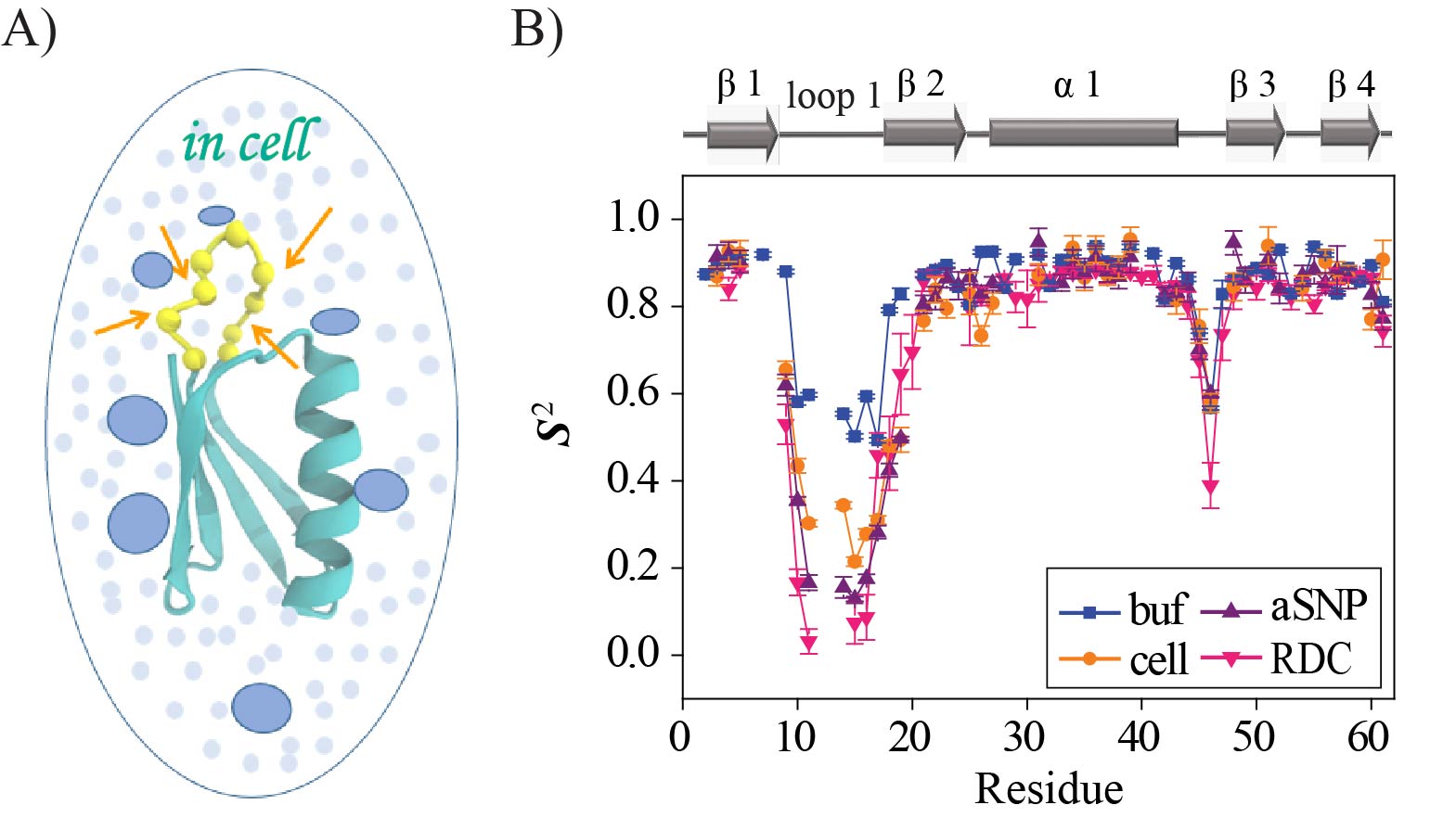
图6. 在水溶液和细胞内测量的蛋白质GB3L构象动态性的比较
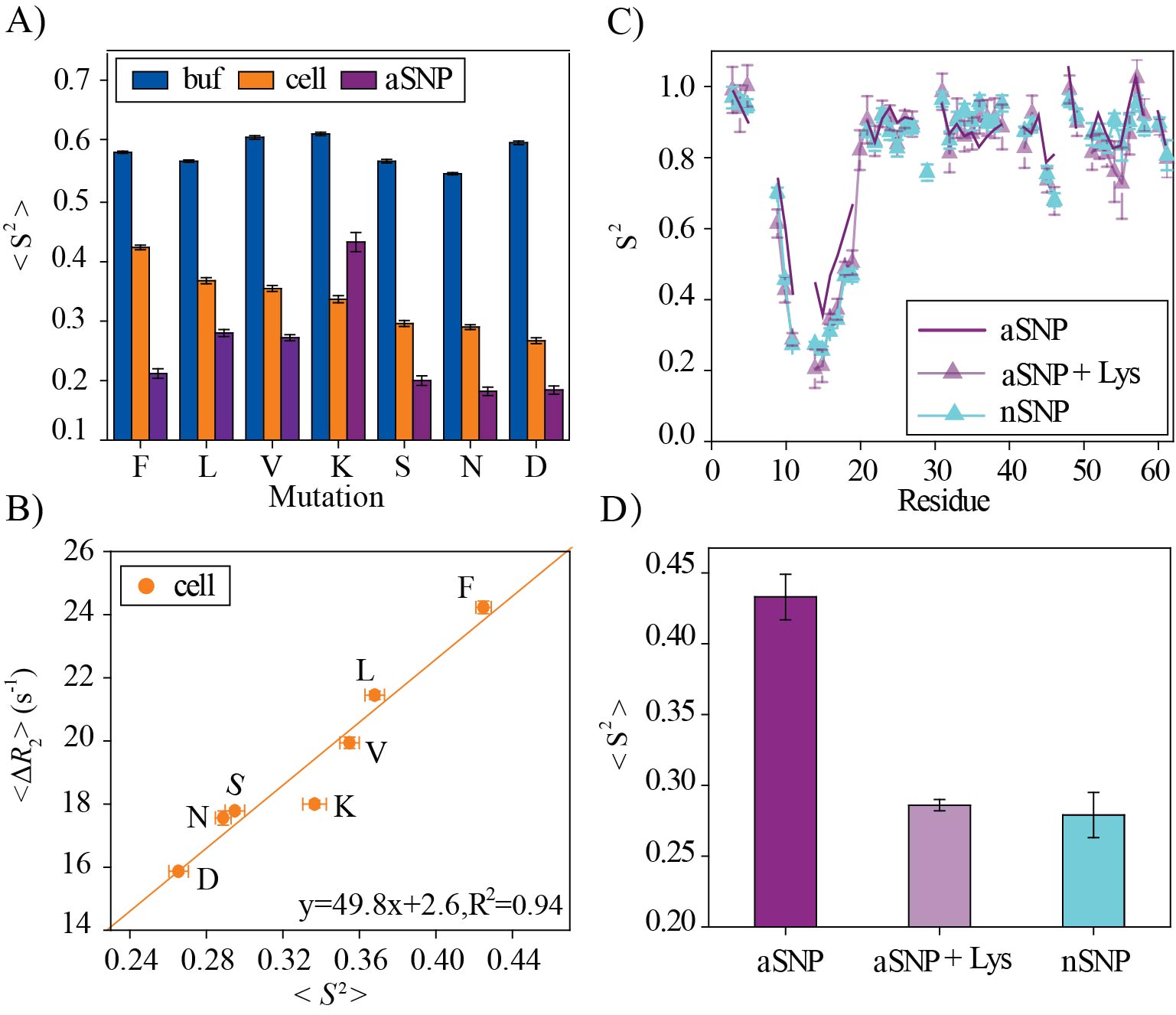
图7. GB3L 环loop1构象动态性与序列关系。A) 不同突变体在不同条件的序参数S 2比较;B) 细胞内环loop1 S 2的平均值与细胞环境弱相互作用的相关性;C)和D) GB3L环loop1 (K突变体)与阴离子纳米颗粒 (aSNP)之间的静电吸引抑制了环 loop 1 的构象动态性。
3. 未来研究计划
中共中央和中共山东省省委制定的“十四五”规划纲要都明确提出“把保障人民健康放在优先发展的战略位置,包括面向人民生命健康加快科技创新驱动发展”。所以未来我们的研究方向除了延续模式蛋白质在大肠杆菌体系的弱相互作用和动态性的研究之外;另一个重点研究的方向,将在现有工作的基础之上,拓展研究功能蛋白质在哺乳动物细胞体系上的性质、功能和药物筛选的研究。