酶催化机理解析和理性设计
1. 研究背景
生物质是唯一可大规模再生的有机碳源,其开发利用可实现CO2循环,对降低PM2.5等大气污染物的排放也有重要作用。其中,生物质液体燃料可直接替代成品油,被认为是今后几十年中最具潜力的可再生能源之一。目前,第一代生物燃料技术相对成熟,已实现较大规模的商业化生产,但存在“与粮争地”、“与人争食”的问题。开发利用秸秆、杂草等农林废弃物中的木质纤维素生产先进生物燃料,成为当前生物能源领域的主要发展方向。2017年,《山东省“十三五”战略性新兴产业发展规划》中明确提出推广发展生物质能,提高生物液体燃料的供给水平,以燃料乙醇推广为契机,研发生产生物燃料乙醇、生物柴油、航空生物燃料、合成生物燃油的先进工艺和成套设备。

图1. 糖平台生物燃料转化示意图
分子模拟是一种计算机辅助的模拟分子行为的技术方法,提供了在分子层面的微观信息,被广泛应用在生物、生物化学和生物物理学方面。随着计算方法的不断改进和计算机的高速发展,分子模拟的精度和效率都有了很大的提高。近些年我们研究组将分子模拟方法与分子生物学/酶学技术结合,在酶的催化机理解析和理性设计方面也做了大量的工作。代表性成果如下:
2.代表性研究工作
来源于里氏木霉的内切葡聚糖酶Cel7B能同时水解纤维素和半纤维素,且水解半纤维素的能力要远高于Cel7A、Cel6A和Cel5A。我们利用理性设计的方法提高了Cel7B对木聚糖的水解活性(图2)。其中组合突变体与滤纸和碱处理的玉米秸秆反应12h,与野生型活性相比,对碱处理的玉米秸秆和滤纸的活性分别提高了35%和45%。该研究成果为通过协同效应,从而提高里氏木霉混合酶系降解纤维素的能力提供了更多的选择性,同时证明了理性设计的方法在提高Cel7B水解活性是有效的,该方法同时为其他纤维素酶等的活性设计也提供了一定的借鉴作用。(Biotechnol. Bioeng. 2016, 113, 1171-1177)。
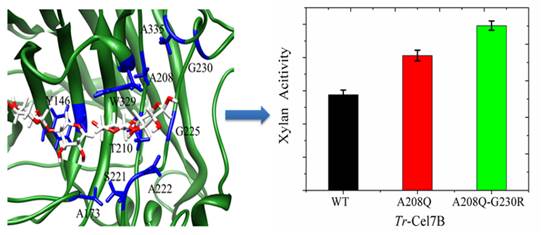
图2 Cel7B的理性设计和实验结果图
此外我们还研究了Cel7B-CD在纤维素表面的吸附机制研究(图3),应用计算模拟方法构建Cel7B-CD与纤维素表面吸附模型,确定了在吸附过程中起主要作用的氨基酸残基及区域。实验表征了Cel7B-CD各靶点氨基酸突变后对滤纸和溶胀纤维素吸附能力的影响和各突变体对不同底物的活性。结果表明,Cel7B-CD的吸附能力的变化对酶的活性影响较小,酶对不溶纤维素底物的活性与人工可溶底物PNPL活性成正相关的作用,酶与不溶底物反应24h活性的高低取决于酶起始催化速度(A值)的高低;随着水解时间的延长,酶的催化速率越来越小,而这种活性变小的趋势与A值成负相关的作用;通过该实验我们获得了4个突变体(N52D,N323D,S324A和S346A)对纤维素的水解活性提高了30%左右。(Enzyme Microb. Tech. 2016, 87-88, 9-16.)。
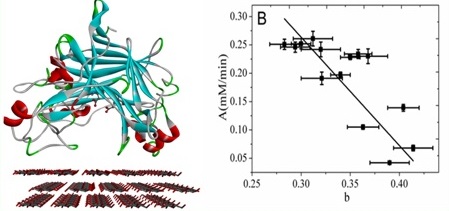
图3 Cel7B的理性设计和实验结果图
为进一步研究Cel7B-CD的水解机制,我们研究了Cel7B-CD在纤维素表面的滑移机制(图4),应用计算模拟方法构建Cel7B-CD与纤维素表面滑移模型,模拟纤维素链在酶催化裂槽里的滑移过程,确定了在滑移过程中起主要作用的氨基酸残基及区域,选择突变的氨基酸位点。结果发现滑移能力大小的实验值与理论计算的值拟合的非常好,酶的活性与滑移能力呈负相关的关系。(Biotechnol Bioeng., 2016, 113, 1873-1880.)。上述研究结果表明,通过理性设计来改造酶的活性是高效且可行的,且该方法路径同样可以适用于其他酶体系的理性改造中。
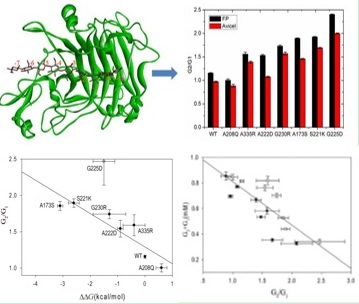
图4 Cel7B的理性设计和实验结果图
3. 未来研究计划
1)基于蛋白质动态性的前药酶yCD的理性设计与结构动态性的研究
普遍的观点认为,蛋白质的动态性对于维持蛋白质的结构与功能有着重要作用,但相比于结构方面的研究,动态性与蛋白功能之间的研究仍然偏少,需要进一步深入的了解。同时,目前蛋白相关的理性设计往往基于其序列及结构信息,根据蛋白动态性进行设计的尝试较少。因此,本研究选择了一种重要的,能通过动态性调控活性的前药催化酶——酵母胞嘧啶脱氨酶(yCD)为研究对象,深入了解蛋白质动态性对催化活性的调控机制,并以之为模板设计提高蛋白动态性(局部热力学性质)的突变体及融合蛋白,获得并表征具有更优催化性质的酶,进一步确定根据蛋白质动态性进行蛋白理性设计的可能性与可行性,提供一种新的蛋白质理性设计思路。
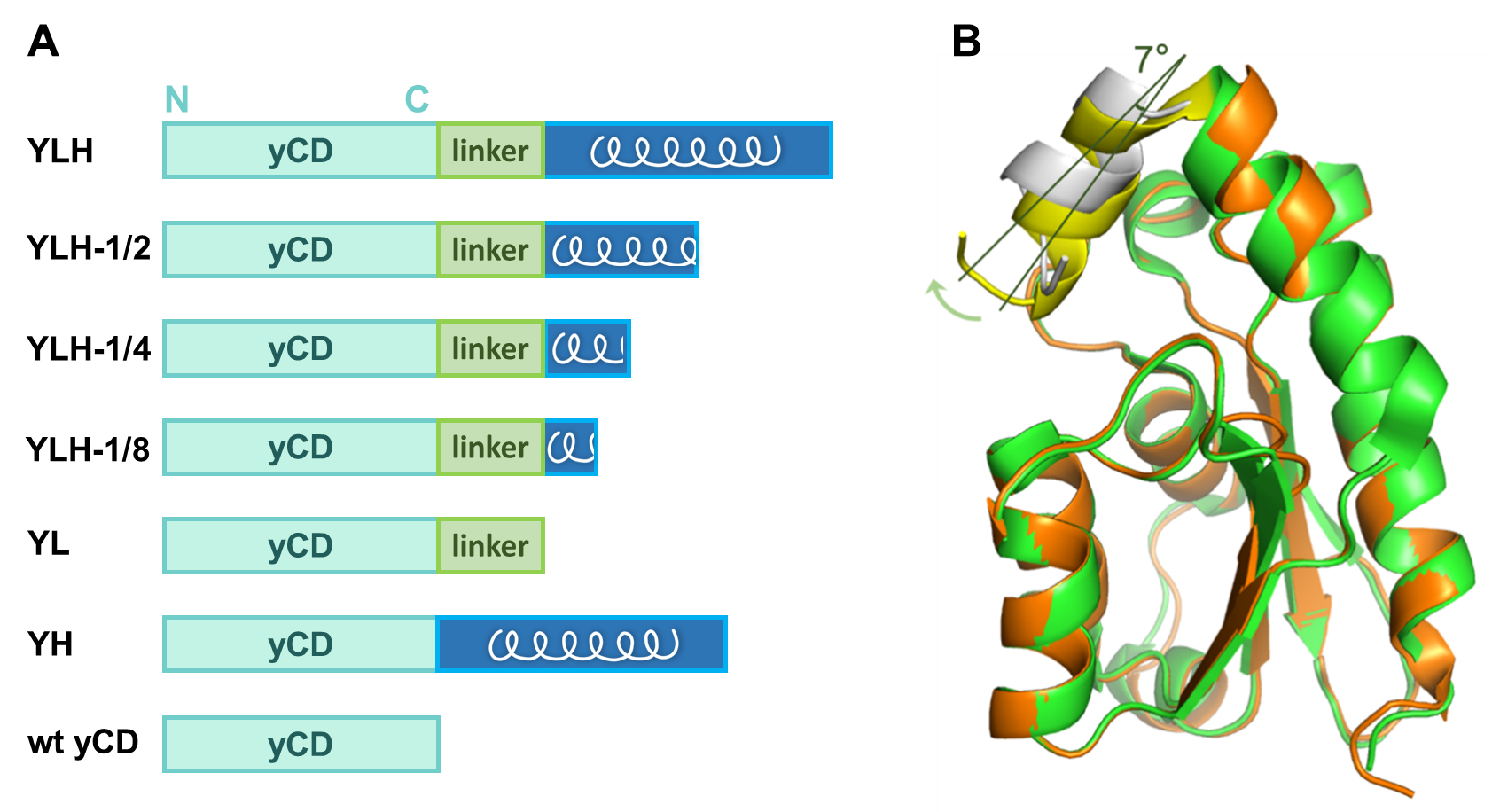
图5. (A)不同α螺旋融合形式的yCD序列示意图。(B)野生型 yCD与YL的晶体结构。其中野生型yCD为绿色,其C末端 lid结构域为黄色。YL结构为橙色,其C末端 lid结构域为灰色。