蛋白质作用力的研究
1. 研究背景
蛋白质是生命体中的重要功能单元,在代谢物反应催化、 DNA 复制、分子传输等过程中起重要作用。当蛋白质多肽链被核糖体合成之后,通常会迅速折叠形成特定的三维结构。组成蛋白质的氨基酸原子之间的作用力(如氢键、静电、范德华力、疏水作用等)驱动了蛋白质的折叠,决定了氨基酸序列和蛋白质结构之间的关系。从某种意义上说,结构“果”而作用力是“因”。 蛋白质的结构测定为理解其功能提供了不可或缺的信息,结构解析技术如晶体衍射、冷冻电镜、核磁共振等的蓬勃发展为结构生物学研究提供保障。然而,蛋白质功能的实现是通过蛋白质分子间(如蛋白质和配体之间)或分子内作用力驱动动态过程来完成的。 因此在获得蛋白质结构之后,对于蛋白质作用力的定量测量有助于深入理解蛋白质与配体的识别、酶催化机理、蛋白质的折叠机制等。另外,经过近几十年的发展,基于理论计算的作用力模型已经可以用来帮助设计新的蛋白质和酶。例如,DavidBaker 实验室设计了若干功能蛋白质或酶,在顶尖杂志 Science 和Nature上发表系列文章。然而,现有的蛋白质设计成功率很低(很多设计序列不能正确折叠),并且人工设计酶的催化活性也远低于天然酶。主要是因为现有的分子作用力模型精度不够高,离设计所需的精度仍有较大差距。对于蛋白质作用力的实验测量将有助于对现有分子作用力模型进行优化,从而实现高效蛋白质设计。
2. 代表性研究工作
1)发展蛋白质盐键高精度测量新方法,解析盐键形成机制
当带正电荷的氨基酸残基和带负电荷的氨基酸距离较近时就会形成盐键,盐键作用力在蛋白质中很常见。盐键的测量通常可以通过 pH 滴定法检测带电氨基酸的DpKa 数值来实现。由于pH计自身的测量误差,以及不同样品之间的细微差异(如缓冲液成分、测量温度等),导致DpKa 的测量误差较大。我们发展了一种新的盐键检测方法,通过结合选择性同位素标记和新脉冲序列设计,显著提高测量精度(~20 倍,图1)。使用该方法,我们对 GB3 蛋白质的四对侧链盐键(强度为 0.4-1.3 kcal/mol)在不同温度下的强度进行了检测。 高精度的测量方法使得我们首次捕捉到随着温度的升高,盐键强度变得更强(图 1D)。范霍夫方程拟合表明, 盐键形成是由熵驱动实现的。理论计算表明,结合在带电氨基酸周围的水分子在盐键形成后被释放,增加了体系的熵值。通过该工作,我们实现了蛋白质盐键的高精度测量,并揭示了蛋白质盐键的熵驱动形成机制( Angew. Chem. Int.Ed., 2017, 56:7601)。
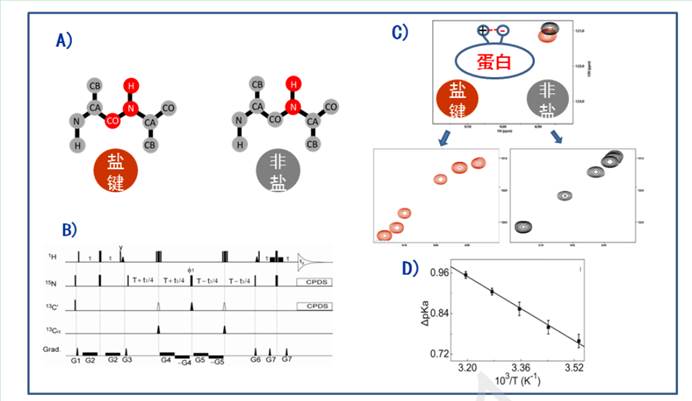
图 1. 蛋白质盐键高精度核磁共振测量。 盐键测量瓶颈在于环境干扰因素和 pH测量误差。为了解决这一问题,我们把带有盐键的样品(红色)和非盐键的样品(灰色)采用不同同位素标记(A),放入同一核磁管中并进行pH滴定,设计同位素过滤核磁共振脉冲序列(B) 来分离两种蛋白质的信号(C),并进行数据拟合获得 pKa 数值,该数值体现了盐键的强弱。通过该方法可以有效排除样品差异和 pH 计测量误差的影响, 显著提高盐键测量精度,并首次捕捉到盐键随温度升高而增强(D)
2)发展蛋白质范德华作用力研究新方法,解析范德华力的作用机制
范德华力被认为是蛋白质折叠和识别的重要贡献力。然而,在蛋白质中的原子间范德华力的直接检测一直未能实现。鉴于此,我们提出利用原子间 J-耦合常数与轨道重叠关联的检测原理,通过检测 J-耦合常数来表征范德华力。由于范德华力自身较弱,对应的J-耦合常数应该也非常小。为了突破这一检测瓶颈,我们发展了一种新的核磁共振检测方法,用以检测蛋白质甲基基团碳原子与其它脂肪族侧链碳原子之间的跨范德华力的 J-耦合常数(图 2)。首先,通过对亮氨酸、异亮氨酸和缬氨酸的甲基进行[13C, 1H]选择性标记(对其它所有氨基酸进行[13C, 2H]标记), 来减少蛋白质中高磁旋比原子核( 1H)的密度(图 2A)。然后,设计 HMQC 实验脉冲序列(图 2B),利用多量子自旋较长的横向弛豫时间来实现磁化矢量到其它碳原子上的传递( 图 2C, D)。从而实现蛋白质内部跨范德华力的 JCC-耦合常数测量(数值在~0.1-0.3 Hz 之间)。进一步的量子力学计算表明,跨范德华力的 JCC-耦合常数与范德华力的交换互斥能组分正相关( 图 2E),即所测得的交换互斥能应该在~0.2-0.6 kcal/mol。通过该工作,我们首次实现了蛋白质内部的跨范德华力的 JCC-耦合常数测量, 并对原子间范德华交换互斥能进行表征(J. Am. Chem. Soc., 2018, 140: 3194),该工作为后续的原子间范德华力相关研究奠定基础。
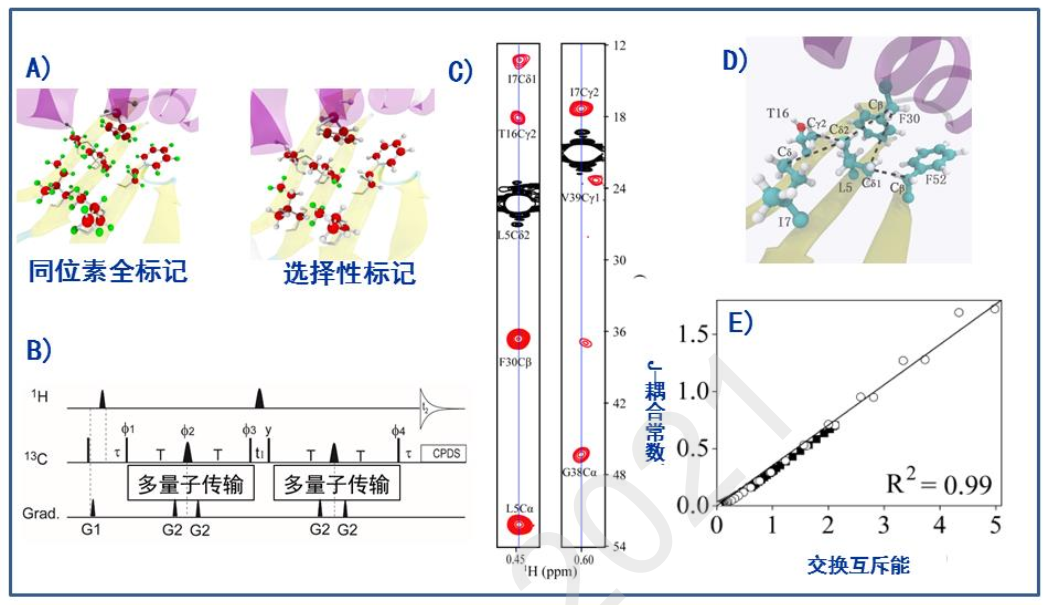
图 2. 蛋白质原子间范德华力的核磁共振测量。 由于范德华力较弱, 尚无其它方法能够实现对其直接检测。我们提出利用原子间 J-耦合常数与轨道重叠关联的新原理,来测量跨范德华力的 J-耦合常数,进而表征范德华力。为了实现检测,我们采用选择性同位素标记技术(A),并设计基于多量子传输的 HMQC 脉冲序列(B) 来优化原子核自旋的传递效率。通过该优化策略,我们首次实现了蛋白质内部的跨范德华力的 JCC-耦合常数测量(C, D)。进一步计算表明(E),我们测量的 JCC-耦合与范德华力的交换互斥能线性相关。
3)发展检测蛋白质氢键耦合和协同性的核磁共振新方法,揭示氢键网络的协同性机制
氢键是促进蛋白质折叠的重要作用力,在蛋白质的功能实施过程中起着举足轻重的作用。氢键协同性描述了不同氢键的耦合关系,本质上是一种多体作用力。例如,在阿尔茨海默疾病中,可溶多肽形成b-折叠片淀粉蛋白纤维过程中,氢键的协同性被认为加快了蛋白质纤维化过程。 然而一直以来没有一种方法能够直接测量蛋白质氢键的协同性。我们提出一种基于氢氘(H/D)交换的蛋白质氢键协同性检测新原理。利用 H/D 的质量差异,扰动蛋白质主链 N-H…O=C 的氢键(H/D原子的质量差异导致 N-H 键非简谐振动差异),并检测周围其它氢键的响应。 如果周围某个氢键发生变化,那么相应的主链原子化学位移也会变化,这一变化可以通过核磁共振来捕捉到。 利用这一检测原理,我们发现,在a-螺旋里,对于一个主链氢键的扰动,会影响到相邻的 6 个主链酰胺化学位移,体现出了协同效应(图 3)。理论计算表明, 实验中观测到的同位素效应主要来自于氢键的静电极化效应, 从而揭示了氢键协同性的机制。结合实验和计算数据,我们估计氢键的协同性增强了a-螺旋中氢键的强度~25%左右(~1 kcal/mol/氢键)。 该工作首次利用跨氢键的 H/D 同位素效应, 实现了蛋白质的a-螺旋中氢键的协同性表征,揭示了氢键协同性对于蛋白质a-螺旋折叠的重要性(J. Am. Chem. Soc., 2016,138:1824)。 论文评审专家认为我们发展的方法是一种 “elegant NMRapproach”。该论文被德国 Ruhr 大学的 Martin Brune 教授在医学权威综述期刊Neurosci. Biobehav. Rev.(2016, 68: 134)中引用评价, Brune 认为在神经和行为科学中的应激响应机制最终可追朔到我们检测到的氢键协同性(氢键应激响应)。
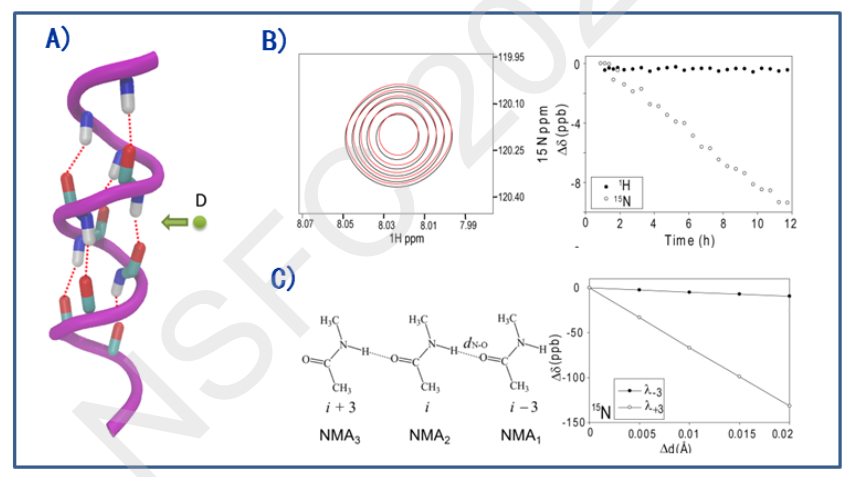
图 3. 氢键协同性的核磁共振检测。 目前尚无其它方法能够测量蛋白质氢键协同性。 我们提出一种基于氢氘(H/D)交换的蛋白质氢键协同性检测新原理方法。具体包括: 酰胺的 H 被 D 交换取代后(左图 A)扰动了自身 N-H···O=C 氢键,并引起周围氢键相应, 表现在远程酰胺的 N, H 的化学位移变化(右图 B)。 结合量化计算表明(C),远程化学位移变化体现了a-螺旋氢键的协同性。
3. 未来研究计划
在未来几年,我们的主要研究方向是针对药物靶标蛋白质体系,发展静态与动态作用力核磁共振检测方法,结合结构与动态性检测技术,解析在原子层面的蛋白质功能和疾病形成机制,寻找新的药物靶点,并在此基础上辅助设计氨基酸序列获得性能更优的蛋白质药物(图 4)。
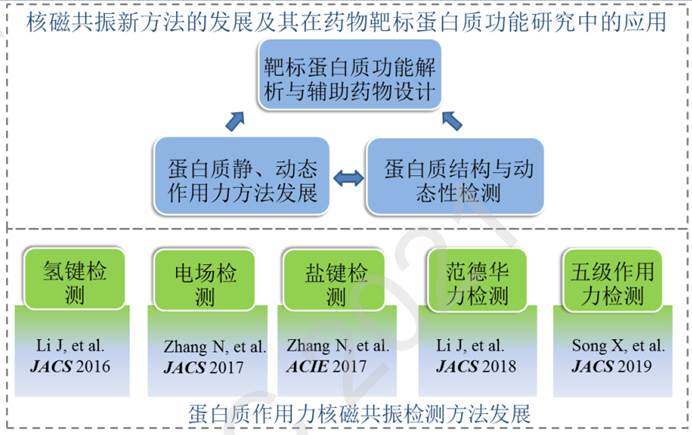
图4. 未来研究方向